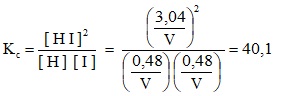El equilibrio químico
En muchos sistemas químicos, los reactivos (o sustancias reaccionantes) se combinan entre sí para formar los productos correspondientes de acuerdo con la reacción que tenga lugar. Sin embargo existen reacciones en las cuales también es posible que los productos formados puedan combinarse entre sí y regenerar los reactivos iniciales. Esto es lo que se conoce como reacciones reversibles. Como consecuencia de esto, existen unas determinadas condiciones de temperatura, presión y concentración bajo las cuales reactivos y productos coexisten en quilibrio.
Así pues, el equilibrio químico es el estado en el que se encuentra un sistema y en el cual no se observa ningún tipo de reacción o cambio, como si la reacción ya hubiese terminado. Sin embargo ésto no es cierto ya que el equilibrio químico es un estado dinámico en el cual se igualan las velocidades de las reacciones directa e inversa. Dicho de otra manera, la velocidad con la que los reactivos se transforman en productos es la misma que la velocidad con la que los productos se transforman en los reactivos iniciales. Por eso no se aprecia reacción alguna. En este punto, las concentraciones de las especies que intervienen en el sistema no se modifica, pero las reacciones directa e inversa continuan, simultáneamente y con la misma velocidad.
Para entenderlo mejor, veamos un ejemplo:
Así pues, el equilibrio químico es el estado en el que se encuentra un sistema y en el cual no se observa ningún tipo de reacción o cambio, como si la reacción ya hubiese terminado. Sin embargo ésto no es cierto ya que el equilibrio químico es un estado dinámico en el cual se igualan las velocidades de las reacciones directa e inversa. Dicho de otra manera, la velocidad con la que los reactivos se transforman en productos es la misma que la velocidad con la que los productos se transforman en los reactivos iniciales. Por eso no se aprecia reacción alguna. En este punto, las concentraciones de las especies que intervienen en el sistema no se modifica, pero las reacciones directa e inversa continuan, simultáneamente y con la misma velocidad.
Para entenderlo mejor, veamos un ejemplo:
En un recipiente vacío de 1 litro introducimos una cierta cantidad de N2O4 y lo calentamos a 150ºC, manteniendo constante dicha temperatura durante toda la prueba. Al cabo de un tiempo t se puede observar que en interior del envase el gas inicial incoloro, se va convirtiendo en un gas de color pardo-rojizo correspondiente al NO2 que se está formando. Este color pardo-rojizo se va acrecentando hasta llegar a un punto en el cual la tonalidad ya no se modifica. Esto nos indica que el sistema ha alcanzado el equilibrio a esa temperatura. El proceso que ha tenido lugar es la descomposición térmica del N2O4 en NO2. Inicialmente se descomponen las moléculas de N2O4 para transformarse en NO2 hasta que se alcanza el equilibrio químico del sistema, punto en el cual el nuevo NO2 que se va formando se recombina para generar el N2O4 inicial.
Como ya he mencionado, el equilibrio de un sistema es un proceso dinámico y aunque no se observe ningún cambio aparente en un sistema en equilibrio, tiene lugar una actividad continua ya que se producen simultáneamente las reacciones directa e inversa, ambas a la misma velocidad.
El equilibrio químico de un sistema se estudia a través de la constante de equilibrio de la reacción que tiene lugar. Dicha constante está relacionada con las concentraciones de las especies que participan en la reacción de la siguiente manera.
Sea como ejemplo el siguiente sistema general (homogéneo):
La constante de equilibrio de este sistema está dada por:
Siendo [A], [B], [C] y [D] las concentraciones de las especies A;B;C y D presentes en el sistema y a,b,c y d los respectivos coeficientes estequiométricos de las especies presentes en la reacción.
El valor de esta constante nos proporciona información acerca del progreso de la reacción y su rendimiento, de tal manera que si:
Kc > 1 → las concentraciones de los productos son mayores que las de los reactivos
Kc >>> 1 → el rendimiento de la reacción es alto ya que este valor indica que la reacción está muy desplazada hacia la derecha y por lo tanto que los reactivos se han transformado en los productos correspòndientes en un alto porcentaje
Kc < 1 → indica que la concentración de los reactivos es mayor que la de los productos formados
Kc <<< 1 → el quilibrio se encuentra desplazado hacia la izquierda y que la concentración de los productos es muy baja y por lo tanto el rendimiento de la reacción es bajo o muy bajo
En los sistemas heterogéneos, esto es, aquellos sistemas en los cuales hay sustancias en diferentes fases, como por ejemplo sólido y gas, la expresión de la constante de equilibrio incluye únicamente las concentraciones de aquellas especies químicas que se encuentran en estado gaseoso ( o iónico), ya que a una determinada temperatura las concentraciones de líquidos y sólidos se consideran constantes. Por ejemplo, la constante de equilibrio de los siguientes sistemas son:
1) Temperatura:
La variación de la temperatura afecta a los sistemas en equilibrio ya que la constante de equilibrio es función de la temperatura (hay reacciones que son endotérmicas y reacciones que son exotérmicas). De acuerdo con el principio de Le Chàtelier, ante un cambio de la temperatura el sistema evoluciona de forma que se opone a esta variación, esto es, si se aumenta o disminuye la temperatura de un sistema en equilibrio, éste procederá en la dirección en que se minimice esta alteración, o lo que es lo mismo, la reacción se desplaza en sentido contrario.
2) Concentración de las sustancias presentes:
Si se aumenta la concentración de los reactivos, la reacción se desplazará hacia la derecha, favoreciendose la formación de los productos. De igual manera, si se incrementa la concentración de los reactivos la reacción se desplaza hacia la izquierda favoreciéndose la formación de los reactivos.
3) Volumen:
Si se disminuye el volumen en una reacción, el sistema se desplaza en el sentido donde ocupe un volumen menor, donde haya un menor número de moles de especies en estado gaseoso.
4) Presión:
Si en un sistema se disminuye la presión, el sistema se desplazará en la dirección en la cual ocupe un mayor volumen.
Para la resolución de ejercicios sobre equilibrios químicos es aconsejable seguir los siguientes pasos:
1º) Escribir la reacción química correspondiente y debidamente ajustada
2º) Escribir la expresión de la constante de equilibrio e identificar la incógnita
3º) Construir una tabla donde se especifiquen los siguientes datos:
5º) Si en el problema se especifica la presión del sistema y ls especies que intervienen son gases es conveniente añadir la fracción molar de cada una de las especies gaseosas así como calcular también la presión parcial de cada uno de los gases
Ejercicio 1
Se hacen reaccionar 4g de hidrógeno con 508g de yodo a una temperatura de 448 ºC. Una vez se alcanza el equilibrio se han formado 389g de yoduro de hidrógeno. Calcular el valor de la constante de equilibrio a la temperatura indicada.
Datos de masas atómicas:
I: 127 ; H:1
Solución:
1º) La ecuación que tiene lugar es:
2º) La ecuación de la constante de equilibrio es:
3º) Necesitamos conocer las concentraciones de las especies presentes en el sistema cuando se alcanza el equilibrio. Las calculamos de la siguiente manera:
N2O4 <===> 2 NO2
La ley del equilibrio químico: La constante de equilibrio
Como ya he mencionado, el equilibrio de un sistema es un proceso dinámico y aunque no se observe ningún cambio aparente en un sistema en equilibrio, tiene lugar una actividad continua ya que se producen simultáneamente las reacciones directa e inversa, ambas a la misma velocidad.
El equilibrio químico de un sistema se estudia a través de la constante de equilibrio de la reacción que tiene lugar. Dicha constante está relacionada con las concentraciones de las especies que participan en la reacción de la siguiente manera.
Sea como ejemplo el siguiente sistema general (homogéneo):
a A + b B <==> c C + d D
La constante de equilibrio de este sistema está dada por:
Siendo [A], [B], [C] y [D] las concentraciones de las especies A;B;C y D presentes en el sistema y a,b,c y d los respectivos coeficientes estequiométricos de las especies presentes en la reacción.
El valor de esta constante nos proporciona información acerca del progreso de la reacción y su rendimiento, de tal manera que si:
Kc > 1 → las concentraciones de los productos son mayores que las de los reactivos
Kc >>> 1 → el rendimiento de la reacción es alto ya que este valor indica que la reacción está muy desplazada hacia la derecha y por lo tanto que los reactivos se han transformado en los productos correspòndientes en un alto porcentaje
Kc < 1 → indica que la concentración de los reactivos es mayor que la de los productos formados
Kc <<< 1 → el quilibrio se encuentra desplazado hacia la izquierda y que la concentración de los productos es muy baja y por lo tanto el rendimiento de la reacción es bajo o muy bajo
En los sistemas heterogéneos, esto es, aquellos sistemas en los cuales hay sustancias en diferentes fases, como por ejemplo sólido y gas, la expresión de la constante de equilibrio incluye únicamente las concentraciones de aquellas especies químicas que se encuentran en estado gaseoso ( o iónico), ya que a una determinada temperatura las concentraciones de líquidos y sólidos se consideran constantes. Por ejemplo, la constante de equilibrio de los siguientes sistemas son:
CaCO3 (s) <==> CaO (s) + CO2 (g) → Kc = [CO2]
AgCl (s) <==> Ag+ (ac) + Cl- (ac) → Kc = [Ag+] [Cl-]
Factores que influyen en el equilibrio químico
1) Temperatura:
La variación de la temperatura afecta a los sistemas en equilibrio ya que la constante de equilibrio es función de la temperatura (hay reacciones que son endotérmicas y reacciones que son exotérmicas). De acuerdo con el principio de Le Chàtelier, ante un cambio de la temperatura el sistema evoluciona de forma que se opone a esta variación, esto es, si se aumenta o disminuye la temperatura de un sistema en equilibrio, éste procederá en la dirección en que se minimice esta alteración, o lo que es lo mismo, la reacción se desplaza en sentido contrario.
2) Concentración de las sustancias presentes:
Si se aumenta la concentración de los reactivos, la reacción se desplazará hacia la derecha, favoreciendose la formación de los productos. De igual manera, si se incrementa la concentración de los reactivos la reacción se desplaza hacia la izquierda favoreciéndose la formación de los reactivos.
3) Volumen:
Si se disminuye el volumen en una reacción, el sistema se desplaza en el sentido donde ocupe un volumen menor, donde haya un menor número de moles de especies en estado gaseoso.
4) Presión:
Si en un sistema se disminuye la presión, el sistema se desplazará en la dirección en la cual ocupe un mayor volumen.
Ejercicios sobre el equilibrio químico
Para la resolución de ejercicios sobre equilibrios químicos es aconsejable seguir los siguientes pasos:
1º) Escribir la reacción química correspondiente y debidamente ajustada
2º) Escribir la expresión de la constante de equilibrio e identificar la incógnita
3º) Construir una tabla donde se especifiquen los siguientes datos:
- Línea 1: la ecuación química que tiene lugar debidamente ajustada
- Línea 2: las concentraciones iniciales de las sustancias que participan en la reacción
- Línea 3: Las concentraciones en el equilibrio de las sustancias participantes
5º) Si en el problema se especifica la presión del sistema y ls especies que intervienen son gases es conveniente añadir la fracción molar de cada una de las especies gaseosas así como calcular también la presión parcial de cada uno de los gases
Ejercicio 1
Se hacen reaccionar 4g de hidrógeno con 508g de yodo a una temperatura de 448 ºC. Una vez se alcanza el equilibrio se han formado 389g de yoduro de hidrógeno. Calcular el valor de la constante de equilibrio a la temperatura indicada.
Datos de masas atómicas:
I: 127 ; H:1
Solución:
1º) La ecuación que tiene lugar es:
H2 + I2 <===> 2 HI
2º) La ecuación de la constante de equilibrio es:
3º) Necesitamos conocer las concentraciones de las especies presentes en el sistema cuando se alcanza el equilibrio. Las calculamos de la siguiente manera:
Como no se indica el volumen total vamos a suponer un volumen V para hacer los cálculos. Así se tiene que:
(Siendo n el número de moles de los reactivos)
Una vez conocidas las concentraciones se calcula la constante de equilibrio:
Kc = 40,1
NOTA: obtención de los datos de concentración utilizados en la ecuación de la constante de equilibrio:
Lo primero es pasar las unidades que nos dan en gramos a moles (esto se puede hacer de diferentes formas según los profesores que lo enseñen. Yo prefiero ponerlo en fracciones como indico a continuación. Lo importante es pasar los gramos a moles):
Como en el equilibrio la cantidad de HI que se forma es 3,04 y esto ha de ser igual a 2x, tenemos que:
Ahora simplemente es poner estos datos en la tabla y sustituir las concentraciones que obtenemos en la ecuación de la constante de equilibrio.
.